ATOMOVÁ SPEKTRA SYSTÉNŮ DVOU ELEKTRONŮ He, Hg
SPOLEČNÉ POJMY: Parahelium, ortohelium, výměnná energie, spin, moment hybnosti, spin orbitální interakce, singletové řady, tripletové řady, násobnost, Rydbergovy řady, výběrová pravidla, zakázané přechody, metastabilní stav, energetická hladina, exitační energie.
PRINCIP: Spektrální čáry He a Hg prozkoumáme difrakční mřížky, . Vlnové délky čar jsou určovány prostřednictvím konstanty difrakční mřížky a z geometrického uspořádání.
ZAŘÍZENÍ: Trojnožka
Soudečkový držák
Obr. 1 Experimentální uspořádání na měření spekter He a Hg
PROBLÉM:
USPOŘÁDÁNÍ:
Experimentální uspořádání je na obrázku 1. Izolované držáky přívodu z výstupu napěťového zdroje 7 kV. Metrová škála je zabezpečena ve výšce štěrbiny ochrannou trubicí bezprostředně za spektrální trubicí.
Difrakční mřížka je umístněna v držáku objektů tak, aby rovina difrakce (difrakční rovina) byla kolmo na uspořádání mřížka – štěrbina.
Místnost se zatemní tak, aby bylo možné ještě odečítat na metrové stupnici. Napěťový zdroj se nastaví okolo 5 kV.
Jednotkové čáry (prvního řádu) spektrální lampy se pozorují prostřednictvím mřížky a vzdálenosti 2l mezi stejnými čarami, jak se určí prostřednictvím metrové stupnice.
TEORIE A VYHODNOCENÍ:
![]() Z obr. 2 máme
Z obr. 2 máme
![]() A proto
A proto
![]() 2) Dopadem elektronů se vyvolává excitace He a Hg atomů. Rozdíl energií tvořený návratem energií z exitovaného stavu E1 do základního stavu E0, se vytváří v podobě fotonu s frekvencí f
2) Dopadem elektronů se vyvolává excitace He a Hg atomů. Rozdíl energií tvořený návratem energií z exitovaného stavu E1 do základního stavu E0, se vytváří v podobě fotonu s frekvencí f
kde h = Planckova konstanta = 6,63 × 10-34 J × s
Obr. 2 Difrakce světla s vlnovou délkou l na mřížce
![]() Hamiltonovský operátor (nerelativistický) pro dva elektrony 1 a 2 atomu He je tvaru
Hamiltonovský operátor (nerelativistický) pro dva elektrony 1 a 2 atomu He je tvaru
![]() kde
kde
![]() m a e odpovídají hmotnosti a náboji elektronu, místo
m a e odpovídají hmotnosti a náboji elektronu, místo
![]() je Laplaceův operátor a je umístnění i-tého elektronu
je Laplaceův operátor a je umístnění i-tého elektronu
![]()
![]() Spin-orbitální energii můžeme v případě Z = 2 u helia zanedbat, protože je malá, pokud Z je malé. Uvažujeme – li
Spin-orbitální energii můžeme v případě Z = 2 u helia zanedbat, protože je malá, pokud Z je malé. Uvažujeme – li
![]()
![]() jako interaknčí člen elektron – elektron, potom vlastní hodnoty Hamiltonova operátoru bez interakce jsou stejné jako pro atom vodíku, pro n, m = 1, 2, … Jelikož pravděpodobnost přechodu pro současnou exitaci dvou elektronů je mnohem menší než pro exitaci jednoho elektronu, enrgetické spektrum systému bez interakce je
jako interaknčí člen elektron – elektron, potom vlastní hodnoty Hamiltonova operátoru bez interakce jsou stejné jako pro atom vodíku, pro n, m = 1, 2, … Jelikož pravděpodobnost přechodu pro současnou exitaci dvou elektronů je mnohem menší než pro exitaci jednoho elektronu, enrgetické spektrum systému bez interakce je
Interakční člen snímá degeneraci momentu hybnosti čistého vodíkového spektra a degeneraci výměné energie
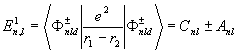 Kde :
Kde :
![]() Jsou antisymetrizované neinterakční dvoučásticové vlnové funkce se symetrickou anebo antisymetrickou složkou koordináty
Jsou antisymetrizované neinterakční dvoučásticové vlnové funkce se symetrickou anebo antisymetrickou složkou koordináty
e* je kvantové číslo momentu hybnosti a místa
V ukázaném případě orbitální moment jednoho elektronu l je roven celkovému momentu hybnostidvou elektronů L, protože jsou uvažovány pouze jednočásticové interakce a druhý elektron zůstává v základním stavu (l=0).
Cnl a Anl jsou Coulombické resp. Výměnná energie, které jsou kladné. Vazba orbitálního momentu hybnosti L a celkovým spinem S dává pro S=0, tj. symetrickou složkou koordináty singletovou řadu, a pro S=1, tj antisymetrickou složkou koordináty pak bipletovou. Kvůli neexistenci spinu orbitální interakce je v tripleti rozštěpení jen málo. Nakolik narušené vlnové funkce jsou vlastní funkce pro S2 a nakolik S2 se mění s dipólovým operátorem, dává ho výběrové pravidlo D S = 0 (které je charakteristické pro 2 – elektronové systémy s nízkým jaderným nábojovým číslem) a zakazuje tak přechody mezi trypletovými a singletovými úrovněmi.
Navíc nezávisle od spin-orbitální interakce výběrové pravidlo pro celkový moment hybnosti D J=0, ± 1 platí s vyjímkou pro J=0 ® J/=0. Pokud je spin-orbitální interakce malá, potom lze použít D L=0, ± 1. Detailní výpočet dává spektrum He na obr. 3.
Obr.3 Spektrum He
Následující tabulka udává naměřené čáry:
|
Barva |
l /nm |
Přechod |
|
Č ervená |
665 ± 2 |
3 1D ® 2 1P |
|
Žlutozelená |
||
|
Zelená |
||
|
Modrozelená |
||
|
Modrá |
||
|
Fialová |
Tabulka 1 – Změřené spektrální čáry He a odpovídající přechody mezi energetickými hladinami.
Veličiny výměnné interakce a Coulombovské interakce dvou elektronů se mohou odhadno
ut porovnáním energií přechodů3 1D ® 2 1P 4 1D ® 2 1P
3 4D ® 2 3P 3 1D ® 2 3P
Podobně He je i Hg dvouelektronový
systém a je tvořený strukturou dvou sérií. Spin-orbitální interakce je ovšem relativně výrazná tak, že pouze celkový moment hybnosti J = L + S je "dobrým” parametrem zachování. Zvýrazněné je i štěpení uvnitř tripletu. Navíc se tu nedá použít výběrové pravidlo D S=0, protože S není "dobrý" parametr zachovávaný (přechod od L-S vazby k vazbě jj).Obr. 4 Spektrum rtuti (Hg)
Tab. 2 Změřené spektrální čáry Hg a odpovídající přech
ody mezi energetickými hladinami.|
barva |
l /nm |
přechod |
|
|
Ž lutá |
|||
|
Zelená |
|||
|
Zelená |
|||
|
Modrá |
Literatura:
PHYWE